Gilteritinib nelle leucemie mieloidi acute FLT3-mutate: l’esperienza italiana real world
Articolo originale: Cairoli R, et al. Gilteritinib in FLT3-mutated acute myeloid leukemia: A real-world Italian experience. Cancer 2025; 131: e70055.
L’analisi di real life italiana (1) analizza la sopravvivenza globale (OS) come primary endpoint e la risposta globale alla terapia come secondary endpoint in 205 pazienti arruolati in 27 centri italiani dal 2018 all’ottobre del 2024, di cui 148 ricevono gilteritinib in prima recidiva e 57 dopo altri trattamenti (fludarabina-citarabina-idarubicina [FLAI], mitoxantrone-etoposide-citarabina [MEC], agenti ipometilanti-venetoclax [HMA-Ven]). Le co-mutazioni più frequentemente riscontrate sono NPM1 (83/175=47,4%), DNMT3A (17/175=9,7%), IDH1/IDH2 (12/175=6,9%) e TP53 (4/175=2,3%).
Nella popolazione globale l’OS mediana è di 10,3 mesi, l’OS a 1 anno è pari al 44,4% e l’OS a 3 anni al 21,3% (Figura 1A). Il tasso di risposte obiettive (ORR) è pari al 52,2%, di cui 43,4% di risposte complete (CR) e 8,8% di risposte ematologiche incomplete (CRi). Dei 107 pazienti in CR o CRi, il 46,1% ha probabilità di essere trapiantato a 1 anno e il 47,3% a 3 anni. I pazienti in CR hanno maggiore probabilità di sopravvivere (65,3% a 1 anno e 39,6% a 3 anni), mentre i pazienti in CRi hanno il 36,1% di OS a 1 anno e il 12% a 3 anni. TP53 (n=6) o l’acquisizione di FLT3 (n=30) sono fattori predittivi negativi di OS (p=0,006 e p=0,022) nei 124 pazienti considerati trapiantabili.
Nei 163 pazienti trattati per recidiva dopo chemioterapia intensiva, 110 pretrattati con inibitori della tirosin-chinasi (TKI) hanno un’OS mediana di 13,2 mesi, (51,3% a 1 anno, 33,9% a 3 anni); 53 non pretrattati con TKI hanno un’OS mediana di 8 mesi (38,4% a 1 anno, 11,1% a 3 anni). La prognosi migliore dei pazienti pretrattati con TKI è possibilmente correlata a una maggiore incidenza in questo gruppo di caratteristiche favorevoli (pazienti più giovani, minore incidenza di leucemie mieloidi acute [LMA] secondarie e ad alto rischio).
Nei 124 pazienti considerati trapiantabili (99 dopo 7+3+midostaurina, 25 dopo FLAI/idarubicina-citarabina-etoposide (ICE)/CPX351; 82 recidivati, 42 refrattari), l’OS mediana è 11 mesi (46,8% a 1 anno, 28,5% a 3 anni) (Figura 1D). L’ORR è pari al 62,9% (52,4% CR, 10,5% CRi). Gilteritinib ha permesso il trapianto in 60 pazienti (48%), dopo una mediana di 112 giorni. I 60 pazienti trapiantati hanno un’OS del 65,2 e del 56% a 1 e 3 anni dal trapianto. Dei 46 pazienti recidivati dopo trapianto allogenico (30 dopo 7+3+midostaurina, 9 dopo 7+3, 7 dopo terapie meno intensive [LIT]), l’OS mediana è pari a 11,1 mesi (49,5% a 1 anno, 15,5% a 3 anni) (Figura 1B). TP53, NPM1, DNMT3A e IDH1/IDH2 non modificano la prognosi. L’ORR è pari al 54,5% (45,7% CR, 8,7% CRi).
Nei 35 pazienti trattati dopo LIT non trapiantabili (17 dopo venetoclax+azacitidina, 11 dopo decitabina, 7 dopo azacitidina; 15 refrattari, 20 recidivati; 14 ad alto rischio secondo la European LeukemiaNet [ELN], 12 con iperleucocitosi), l’OS mediana è di 5,9 mesi (29% a 1 anno) (Figura 1C). L’OS mediana è di 7,5 mesi nei 17 pazienti recidivati dopo venetoclax+azacitidina. L’OS mediana è di 5,3 mesi nei 18 pazienti recidivati dopo ipometilanti. Questo gruppo ha un’aumentata incidenza di pazienti >75 anni, di LMA secondarie e di rischio ELN2017 sfavorevole. L’ORR nei pazienti recidivati dopo LIT è pari all’11,4% (8,6% CR, 2,9% CRi).
Nei 42 pazienti refrattari, l’OS mediana è di 11 mesi (44,2% a 1 anno, 27,9% a 3 anni). TP53 e l’acquisizione di FLT3 peggiorano l’OS e la risposta globale, mentre le mutazioni di NPM1, IDH1, IDH2, DNMT3A non influenzano la prognosi. L’ORR dei 42 pazienti refrattari è pari al 61,9%.
Infine, gli autori commentano le differenze con lo studio registrativo ADMIRAL e gli altri studi real life. Nell’ADMIRAL solo il 12,4% dei pazienti riceve TKI prima di gilteritinib (vs 67,5% della real life italiana), con 21,1% CR, 25,5% CRi e OS mediana pari a 9,3 mesi (2). Nello studio francese ALFA/FILO (n=140), il 37,1% dei pazienti riceve gilteritinib dopo la seconda linea, l’83,6% ha un Eastern Cooperative Oncology Group (ECOG) >1 (16% nell’ADMIRAL), con 25,4% CR+CRi e OS mediana pari a 6,4 mesi (3). Nello studio giapponese (n=67), il 23,4% dei pazienti ha ECOG >1 e il 75% ha multiple comorbidità, con 34,3% CR, 23,9% CRi e OS mediana non riportata (4). Nello studio UK (N=152), il 36% dei pazienti riceve gilteritinib dopo la seconda linea, con 20,5% CR, 8,5% CRi e OS mediana pari a 9,5 mesi (5).
La real life italiana conferma l’efficacia di gilteritinib, mostrando una sopravvivenza maggiore ma paragonabile a quelle dello studio registrativo e delle altre real life e una trapiantabilità del 48,3%. La durata della sopravvivenza è maggiore nei pazienti trapiantabili (Figura 1D) e in quelli trapiantati. I pazienti recidivati dopo LIT e non trapiantabili hanno una prognosi peggiore.
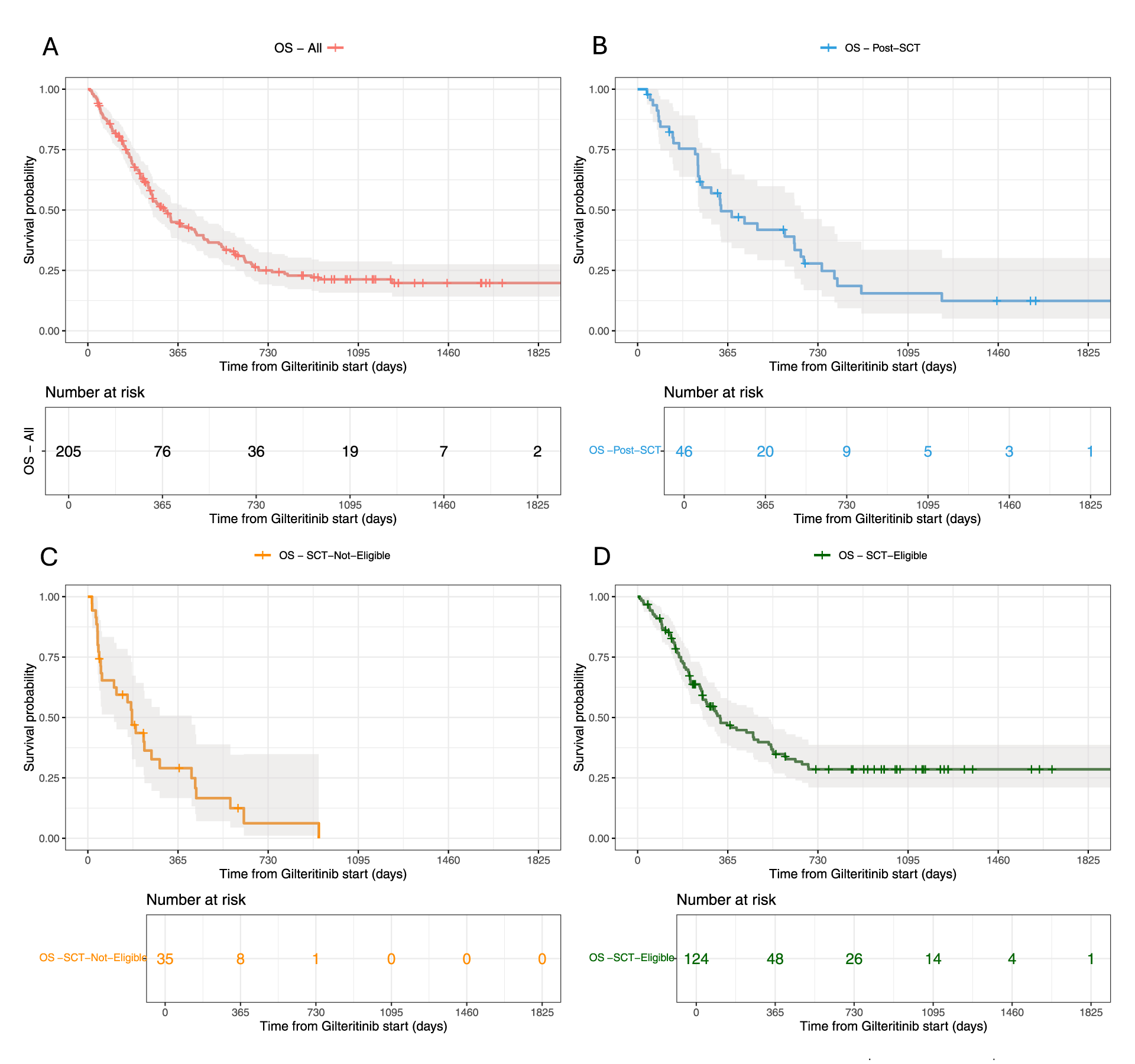
Figura 1. OS basata sull’eleggibilità al trapianto e sulla refrattarietà alla chemioterapia intensiva. A) Popolazione globale; B) Recidivati dopo trapianto allogenico; C) Pazienti ineleggibili al trapianto; D) Pazienti trapiantabili.
BIBLIOGRAFIA
- Cairoli R, et al. Gilteritinib in FLT3-mutated acute myeloid leukemia: A real-world Italian experience. Cancer 2025; 131: e70055.
- Perl AE, et al. Gilteritinib or chemotherapy for relapsed or refractory FLT3‐mutated AML. N Engl J Med 2019; 381: 1728–1740.
- Dumas PY, et al. Gilteritinib activity in refractory or relapsed FLT3‐mutated acute myeloid leukemia patients previously treated by intensive chemotherapy and midostaurin: a study from the French AML Intergroup ALFA/FILO. Leukemia 2023; 37: 91–101.
- Sugamori H, et al. Interim results from a postmarketing surveillance study of patients with FLT3‐mutated relapsed/refractory AML treated with the FLT3 inhibitor gilteritinib in Japan. Jpn J Clin Oncol 2022; 52: 766–773.