BMT-CTN 1506/MORPHO trial: ruolo di gilteritinib nel mantenimento post-trapianto nelle AML FLT3-ITD-mutate
Articolo originale: Levis MJ, et al. Gilteritinib as post-transplant maintenance for acute myeloid leukemia with internal tandem duplication mutation of FLT3. J Clin Oncol 2024; JCO2302474
Lo studio NCT02997202 ha randomizzato 356 pazienti affetti da leucemia mieloide acuta (AML) FLT3-ITD-mutata a ricevere gilteritinib 120 mg/die (n=178) o placebo (n=178) dopo trapianto allogenico per 24 mesi. Il mantenimento con gilteritinib viene completato da 94 pazienti su 178. L’incidenza di graft-versus-host-disease (GVHD) acuta di grado II-IV è sovrapponibile nei due gruppi: 18,5% nel gruppo gilteritinib vs 20,3% nel placebo (p=0,6157). La GVHD cronica è del 52,2% nel gruppo gilteritinib vs 42,4% nel placebo (p=0,181). Gli eventi avversi correlati al trattamento di grado ≥3 sono stati pari all’82% dopo gilteritinib vs 42,4% dopo placebo (p=0,181); tra i più frequenti, descritti rispettivamente nel braccio sperimentale e placebo, abbiamo: neutropenia in 36 vs 13%, piastrinopenia in 21,3 vs 11,3%, anemia in 9,6 vs 7,9%, leucopenia in 10,1 vs 1,7%, rialzo dell’alanina aminotransferasi (ALT) in 6,2 vs 4,5%, rialzo dell’aspartato aminotransferasi (AST) in 6,2 vs 3,4%, ipertensione arteriosa in 6,2 vs 3,4%, rialzo della creatinfosfochinasi (CPK) in 7,9 vs 0,6%. Le tossicità ematologica e infettiva sono state tra le maggiori cause di interruzione precoce del trattamento nel braccio sperimentale rispetto al placebo. L’uso di inibitori di FLT3 (FLT3i), il Sorror score, l’intensità del condizionamento, il tipo di donatore, la fonte della cellula staminale, il rischio citogenetico, lo schema di profilassi della GVHD, l’età mediana, il genere e la razza non sono statisticamente diversi nei due gruppi di trattamento. L’obiettivo primario dello studio è la sopravvivenza libera da recidiva (RFS), mentre la sopravvivenza globale (OS) e l’influenza della malattia minima residua (MRD) pre- e post-trapianto su RFS e OS sono gli obiettivi secondari. Il follow-up mediano è di 43,8 mesi. L’MRD, valutata con le metodiche polymerase chain reaction-next generation sequencing (PCR-NGS) in 350/356 pazienti, è positiva (≥10-6) in 89/178 pazienti trattati con gilteritinib e in 91/178 pazienti del gruppo placebo.
La RFS a 2 anni è maggiore nei pazienti trattati con gilteritinib (77,2 vs 69,9%) ma la differenza non è statisticamente significativa, con hazard ratio (HR) pari a 0,679, p=0,0518. Un’analisi post-hoc ha mostrato un vantaggio in RFS nei pazienti con MRD positiva pre- e post-trapianto (HR 0,515, p=0,0065, Figura 1), mentre i pazienti MRD-negativi non traggono beneficio dal trattamento con gilteritinib (HR 1,213, p=0,575, Figura 1).
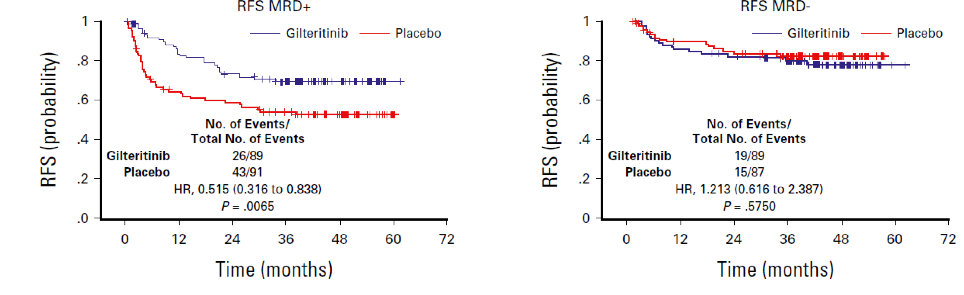
Figura 1. RFS nei pazienti MRD-positivi e MRD-negativi.
Inoltre, gilteritinib determina un beneficio in RFS (HR 0,598, p=0,0436), indipendente dallo stato MRD, nei pazienti che hanno ricevuto i FLT3i pre-trapianto (60% dei casi). Gilteritinib dà un beneficio in RFS vs placebo, indipendente dall’MRD, nel Nord America (HR 0,397, p=0,0022), una RFS inferiore ma non statisticamente significativa in Europa (HR 1,424, p=0,3537), una RFS sovrapponibile in Asia e Pacifico (HR 0,807, p=0,5801). I tre gruppi hanno differenze di trattamento quali il numero dei cicli di induzione e di consolidamento, il tempo dalla diagnosi al trapianto (inferiore in Nord America), l’uso di FLT3i pre-trapianto (maggiore in Nord America), l’uso di azoli (maggiore in Europa) -correlato con maggiori concentrazioni plasmatiche di gilteritinib- e una maggiore tossicità ematologica. Nei pazienti MRD-positivi, la differenza in OS tra il braccio gilteritinib e il braccio placebo non è statisticamente significativa (HR 0,846, p=0,4394), ma il 42,6% (20/47) dei pazienti recidivati nel braccio placebo hanno ricevuto un FLT3i dopo la recidiva (13 gilteritinib, 4 quizartinib, 3 sorafenib). Il condizionamento mieloablativo determina un beneficio in OS rispetto al condizionamento a intensità ridotta (RIC) (HR 0,529, p=0,0027), indipendente dalla MRD. L’incidenza di recidiva è inferiore e la mortalità non correlata a recidiva (NRM) è superiore nel braccio gilteritinib. Lo studio evidenzia un ruolo di gilteritinib in mantenimento post-trapianto nei pazienti con MRD positiva sia pre-, sia post-trapianto. Nei pazienti MRD-negativi, il farmaco espone il paziente a una potenziale tossicità, senza un significativo beneficio in termini di RFS.
BIBLIOGRAFIA