Gli inibitori dei checkpoint immunitari nella leucemia mieloide acuta (AML) e nelle sindromi mielodisplastiche (SMD)
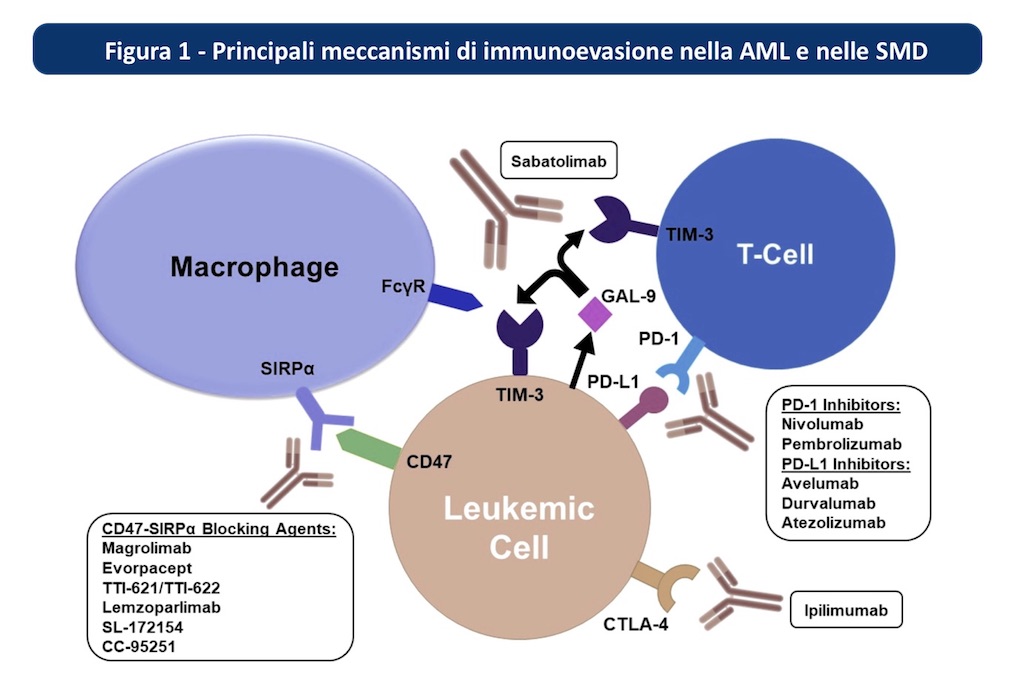
Gli inibitori dei checkpoint immunitari (ICI) ostacolano l’immunoevasione (figura 1) e il loro impiego anche nella AML ha un forte razionale. Numerosi studi sono in corso (riassunti di seguito), ma ad oggi non ci sono ancora evidenze sicure di efficacia derivanti da studi clinici di fase III. Dati preclinici sulla combinazione di inibitori PD1/PDL1 e blocco combinato delle vie TIM-3/galectina-9 e CD47 forniscono il razionale per future associazioni. Il setting ideale d’impiego degli ICI è la fase iniziale della terapia quando è presente una popolazione più numerosa di cellule T CD3+/CD4+/CD8+ e una minore taglia di malattia, per eradicare l’MRD. Da esplorare la combinazione nivolumab+azacitidina orale nel mantenimento. L’associazione azacitidina-magrolimab è la più interessante nelle AML TP53 mutate.
Anti-CTLA-4
CTLA-4 inibisce in maniera competitiva il legame del recettore costimolatorio delle cellule T, CD28, ai ligandi CD80 e CD86, ostacolando l'attivazione delle cellule T. Ipilimumab in monoterapia ha scarsa efficacia nelle AML e nelle sindromi mielodisplastiche (SML).
Anti-PD1/PDL1
PD-1 è un co-recettore negativo espresso dalle cellule T attivate che, interagendo con il ligando della morte programmata 1 (PD-L1) espresso dalle cellule tumorali, smorza le risposte delle cellule T antitumorali inducendo l'apoptosi delle cellule T e attenuando la risposta immunitaria. Gli inibitori PD-1/PD-L1 in monoterapia sono poco efficaci, ma esiste un razionale di combinazione con gli ipometilanti (HMA) che aumentano l'espressione di PD-1, PD-L1, PD-L2 e CTLA4, degli antigeni tumorali e delle molecole costimolatorie nelle cellule leucemiche e mielodisplastiche e con la citarabina che aumenta l'espressione di molecole costimolatorie da parte dei blasti diminuendo l'espressione di PD-L1.
Nivolumab
Studio fase II: nivolumab e azacitidina in 70 AML in II linea mostra ORR del 33% (22% RC) e OS mediana di 6,3 mesi vs ORR 20% e OS mediana di 4,6 mesi in pazienti trattati con azacitidina con simili caratteristiche. Una seconda coorte dello studio associa ipilimumab con una ORR del 46% e OS mediana di 10,5 mesi, a fronte di un aumento del 25% degli effetti collaterali autoimmunitari.
È in corso studio fase I nivolumab + ipilimumab in AML e SMD R/R post allogenico (NCT02530463).
Nivolumab + citarabina e idarubicina in I linea mostra 78% di RC in 42 AML (79% MRDneg), 19 vengono trapiantate. L’OS mediana è 18,5 mesi, 25 mesi nei trapiantati. Il trapianto non migliora l’OS nei responder.
In uno studio di fase II il nivolumab in mantenimento post-trapianto in 15 AML determina una PFS mediana di 8,5 mesi sovrapponibile a quella storica con risposte MRD negative in 2 pazienti con AML ELN2017 favorevole e intermedio.
Pembrolizumab
Studio fase II: 29 AML in II linea ottengono ORR 55% (14% RC), OS mediana di 10,8 mesi; 17 unfit in I linea ottengono 94% ORR (47% RC) con OS mediana di 13 mesi.
Pembrolizumab + decitabina 10 giorni mostra 6/10 ORR con OS mediana di 10 mesi.
Citarabina alte dosi e pembrolizumab in 37 AML R/R mostrano 46% ORR (38% RC) e OS mediana di 11,1 mesi con 50% di MRDneg, senza incremento di GVHD nei 9 pazienti poi trapiantati dopo 1 dose di pembrolizumab.
In corso due studi fase III per pembrolizumab con CHT (NCT04214249) e azacitidina-venetoclax (NCT04284787) con obiettivo primario di incremento della negatività dell’MRD.
Il farmaco ha fallito l’obiettivo primario di risposta in uno studio di fase Ib (KEYNOTE-013) in SMD alto rischio R/R dopo HMA e in uno studio di fase II associato ad azacitidina nelle SMD ad alto rischio in I e II linea.
L’impiego degli anti PD-1 è complicato dalle difficoltà della gestione e della diagnosi di effetti collaterali immuni quali piastrinopenia severa, polmonite, anemia aplastica.
Inibitori di PD-L1
Non hanno mostrato attività clinica in AML e SMD (avelumab fase I, azacitidina vs durvelumab fase IIR, Fusion-AML-001 in I linea, studio fase Ib/II in II linea). L’aumento di PD-L2 sui blasti e la ridotta espressione di PD-L1 sui monociti sono potenziali ragioni alla base della ridotta efficacia.
Anti CD47-SIRPa
CD47 è il checkpoint immunitario espresso dalle cellule tumorali che legandosi alla proteina regolatrice del segnale alfa (SIRPα) dei macrofagi inibisce la fagocitosi tumorale. Le cellule staminali leucemiche e mielodisplastiche esprimono maggiormente CD47 rispetto alle cellule sane.
Magrolimab
Studio CAMELLIA fase I: AML II linea con 73% di stabilità di malattia.
Azacitidina + magrolimab
Studio fase I AML e SMD I linea (N 91 unfit per CHT) con 91% ORR nelle 33 SMD valutabili (42% RC, 22% MRD neg) e 65% (56% RC, 37% MRD neg) nelle 34 AML valutabili. Le AML TP53 mutate ottengono 67% di RC e OS mediana di 12,9 mesi vs 18,9 mesi delle AML TP53 wt. Studio fase III ENHANCE3 in corso nelle AML TP53 mutata (vs Aza/3+7).
Azacitidina + magrolimab + venetoclax
Studio fase Ib/II in I e II linea in 38 LAM (13 R/R a Venetoclax) con 94% di RC in I linea, 27% nei R/R a Venetoclax e 63% nei Ven-naive.
Evorpacept (ALX148) è una proteina di fusione bloccante CD47, ad alta affinità, ingegnerizzata con un dominio Fc di immunoglobulina umana modificata inattiva che evita l’emolisi.
Azacitidina + evorpacept
Fase I (ASPEN-02) MDS HR dose 60 mg/kg ev/settimanale dà risultati promettenti (3/5 risposte). Aza+Ven+Evorpacept (ASPEN-05) in corso.
INIBITORI TIM-3
Il dominio dell'immunoglobulina delle cellule T e il dominio della mucina-3 (TIM-3), è un altro checkpoint immunitario delle cellule T, espresso dalle cellule staminali leucemiche, associato a un fenotipo immunosoppressivo.
HMA + sabatolimab
53 AML I linea, unfit, ottengono 40% di ORR (30% di RC), con durata mediana di 12,6 mesi e PFS ad 1 anno del 27,9%.
48 SMD HR I linea ottengono ORR del 57% (43% di RC) con durata mediana di 16 mesi e PFS a 1 anno del 51,9%. TP53/RUNX/ASXL1 non riducono le risposte. Il 24,5% delle SMD va al trapianto senza aumentare il rischio di GVHD.
STIMULUS studi fase II e III in AML SMD e LMMC in corso.
BIBLIOGRAFIA