Mutazioni leucemiche distinte convergono su condensati nucleari phase-separated
Articolo originale: Datar GK, et al. Disparate leukemia mutations converge on nuclear phase-separated condensates. Cell 2025; 188: 7118–7136.e21.
I condensati, fasi simil-liquide ad alta complessità che permettono alle proteine di creare network simil-liquidi dinamici ad alta densità all’interno della cellula, sono emersi come un fenomeno ubiquitario che governa quasi tutte le attività cellulari, fungendo da bioreattori, sensori, snodi di signaling e altro. Molti gruppi hanno segnalato condensati patogenici che annettono una rete condivisa di proteine coinvolte nella regolazione del cancro. La comparsa di condensati patogenici come conseguenza di una localizzazione proteica aberrante è un modello avvincente di cancerogenesi (e leucemogenesi).
La mutazione di NPM1 comporta la delocalizzazione di NPM1 mutata (NPM1c) dal nucleo al citoplasma ed è noto come attivi un programma di espressione genica HOXA/MEIS1 essenziale per la leucemogenesi, condiviso con le fusioni di NUP e i riarrangiamenti di KMT2A. Tuttavia, NPM1c, diversamente da NUP98 e KMT2A, non ha un ruolo chiaro nella regolazione cromatinica e non presenta una prevalente localizzazione nucleare nella sua forma mutata. Pertanto, la connessione tra questi sottotipi di leucemia rimane poco chiara, nonostante le espressioni geniche e le sensibilità farmacologiche agli inibitori di MENIN e di XPO condivise che supportano meccanismi comuni.
In questo articolo pubblicato su Cell, vengono identificate tre scoperte chiave rivoluzionarie (Figura 1):
- NPM1c forma dei condensati nucleari: nonostante la sua localizzazione prevalentemente citoplasmatica, NPM1c nella leucemia mieloide acuta (LMA) NPM1-mutata forma condensati nucleari distinti chiamati coordinating bodies (C-bodies), confermati su linee cellulari, modelli murini e campioni primari di pazienti. I C-bodies reclutano proteine coinvolte nell’espressione genica HOXA/MEIS1, tra cui NUP98, KMT2A, MENIN e XPO1, che co-localizzano nei condensati;
- i C-bodies promuovono la leucemogenesi: i C-bodies sono necessari e sufficienti per mantenere l’espressione genica pro-leucemica e per la sopravvivenza della cellula leucemica, bloccando i processi di differenziamento e promuovendo la proliferazione in vivo. La disgregazione dei C-bodies tramite inibizione farmacologica (inibitori di MENIN e di XPO1) o manipolazione genetica ripristina il differenziamento mieloide e riduce la sopravvivenza cellulare;
- meccanismo di convergenza: altre proteine risultanti dalle fusioni geniche che promuovono la leucemia con aberrante espressione di HOXA (KMT2A e NUP98) formano condensati a livello biofisico indistinguibili dai C-bodies promossi da NPM1c. La presenza comune di C-bodies suggerisce che questi ultimi possano essere una caratteristica unificante per molteplici sottotipi di leucemia.
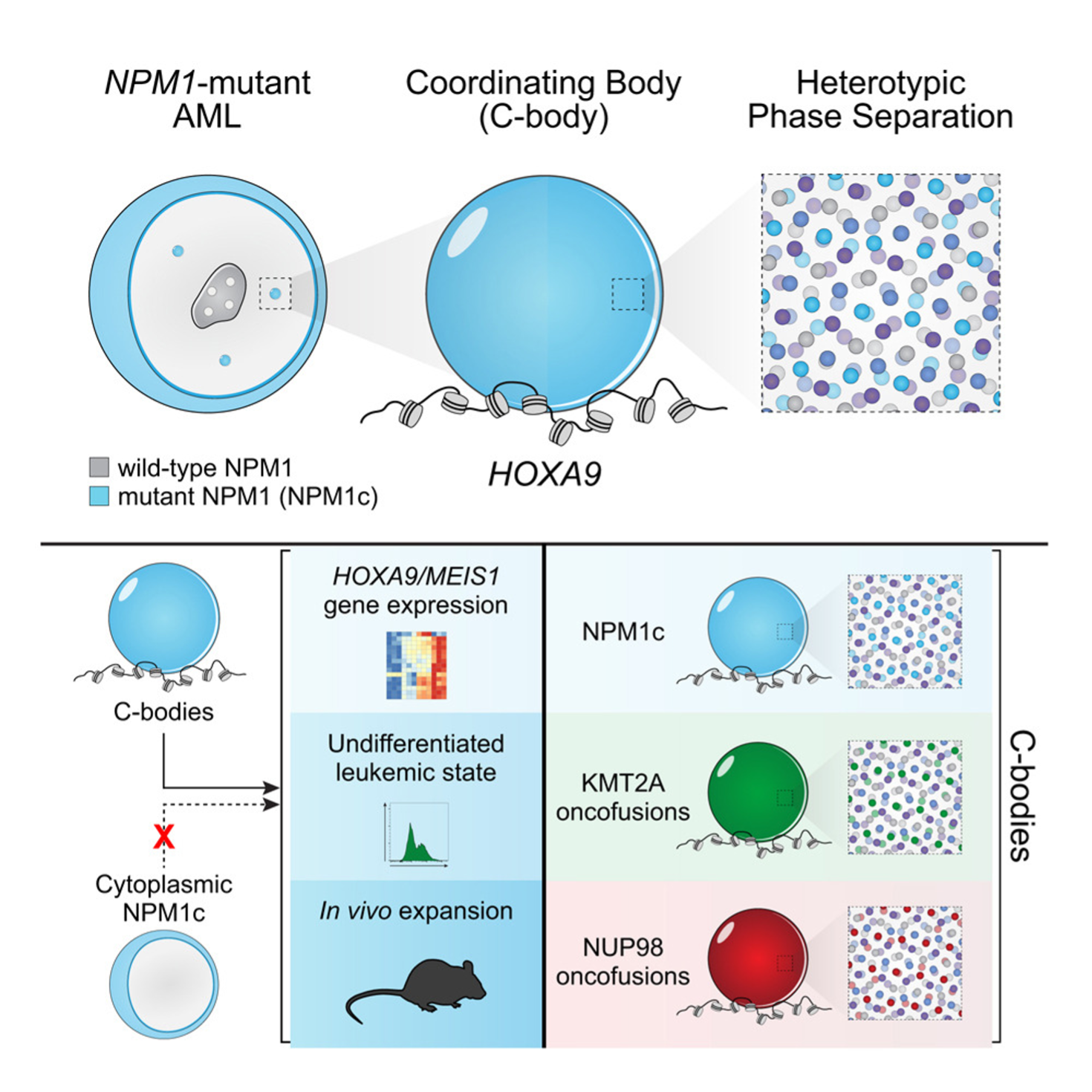
Figura 1. I C-bodies nella leucemia mieloide acuta NPM1-mutata.
Dalla lettura di questo articolo, si comprende più a fondo il motivo del pattern di espressione genica HOXA/MEIS condiviso in sottotipi di leucemia apparentemente distanti. La recente approvazione degli inibitori di MENIN (MENINi) nella leucemia acuta NPM1-mutata ci impone di comprendere meglio i meccanismi biologici a cui assistiamo durante la terapia. Questo studio mostra come il trattamento con MENINi comporti un’alterazione della composizione dei C-bodies. Infatti, sia nei modelli in vivo, sia in quelli ex vivo, l’esposizione a MENINi portava alla deplezione di MENIN dai C-bodies dopo 24 ore, alla regolazione negativa dei geni associati ai C-bodies (HOXA9, HOXA10, MEIS1) dopo 72 ore e al differenziamento in senso monocitario dopo 6 giorni. Lo stesso andamento (perdita di MENIN dai C-bodies e differenziamento monocitario) si osservava nel sangue periferico di pazienti con LMA in trattamento con MENINi, mimando quello che osserviamo spesso nella pratica clinica. Questo suggerisce che l’interazione critica tra MENIN e KMT2A, bersaglio dei MENINi, si verifichi proprio nei C-bodies.
Infine, questo studio suggerisce che i C-bodies possano rappresentare un target terapeutico trasversale, applicabile a più sottotipi di LMA molecolarmente definiti. La scoperta di una struttura nucleare condivisa da cui dipendono più mutazioni unisce concetti di biofisica di base agli aspetti clinici della leucemia. La possibilità di sfruttare come target terapeutico la struttura stessa fornisce una nuova chiave di lettura nella terapia delle leucemie acute.
BIBLIOGRAFIA